Hochpräzise
Lungenfunktionsdiagnostik.
GANSHORN produziert seit mehr als 40 Jahren qualitativ hochwertige und intuitiv zu bedienende Messgeräte für das gesamte Spektrum der Lungenfunktionsdiagnostik.

Innovative Medizintechnik aus Deutschland. Seit über 40 Jahren. Mit der Entwicklung des SpiroScout, einem Spirometer der auf einem kalibrationsfreien, höchst genauen Ultraschall-Fluss-Sensor basiert, öffnet GANSHORN neue Horizonte: gleichzeitige Fluss-, Temperatur- und Gasmessungen ohne merklichen Flusswiderstand für den Patienten. Darauf basierend bietet GANSHORN seinen Kunden hochmoderne Lösungen für Bodyplethysmographie, CO Diffusion, Ergospirometrie und vieles mehr.
-

Spirometrie
-
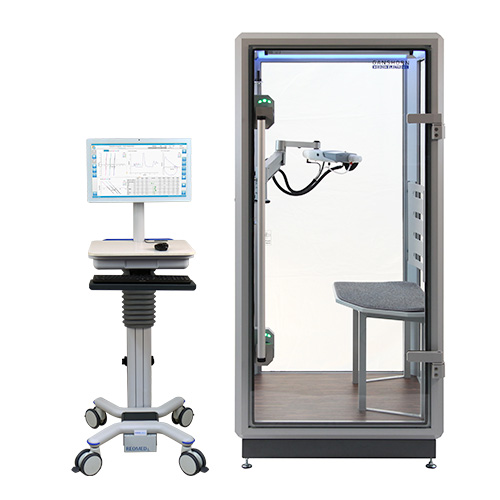
Bodyplethysmographie
-

CO-Diffusion
-

Ergo-Spirometrie
-
Software & Connectivity
-
Weitere Sparten
SpiroScout
Das GANSHORN Spirometer SpiroScout ist ein komplettes Lungenfunktionslabor auf der Basis des Ganshorn-Ultraschall-Flussmessverfahrens. Er ermöglicht die exakte Bestimmung aller spirometrischen Parameter.
- Der erste Schritt für eine schnelle und sichere Diagnose von Asthma, COPD und anderen Lungenkrankheiten.
- Als erstes und weltweit einziges Spirometer misst der SpiroScout gleichzeitig Fluss und Gaskonzentration.
- Ermöglicht mit einer einzigen Messung Aussagen über Fluss-, Volumen- und Atemgasparameter
PowerCube Body+
Der neue GANSHORN Bodyplethysmograph PowerCube Body+ ist das Ergebnis jahrzehntelanger Erfahrung im Bau von Bodyplethysmographen unter Nutzung modernster Technologien.
- Der erste Schritt für eine schnelle und sichere Diagnose von Asthma, COPD und anderen Lungenkrankheiten.
- Als erstes und weltweit einziges Spirometer misst der SpiroScout gleichzeitig Fluss und Gaskonzentration.
- Ermöglicht mit einer einzigen Messung Aussagen über Fluss-, Volumen- und Atemgasparameter.
PowerCube Diffusion+
Diffusions- und Verteilungsstörung in einer Messung
- Die GANSHORN PowerCube Diffusion+ kombiniert kalibrationsfreie Ultraschallsensoren mit den speziell für die schnelle Diffusionsanalyse entwickelten Gassensoren, denn sie bilden die Basis für aussagekräftige Messungen.
- Die Sensortechnologie ist langlebig und erfordert keine Wartung.
- Abwurf- und Entnahmevolumen ist veränderbar, sodass er Patienten bis zu 0,5 l VC messen kann.
PowerCube Ergo
Das bedienerfreundliche und höchst zuverlässige System für die Ergospirometrie
- Ob zur Differentialdiagnostik oder zur medizinisch abgesicherten Betreuung von Sportlern: Die Ergospirometrie ist zum unverzichtbaren Verfahren für die kardio-pulmonale Funktionsdiagnostik geworden.
- Das GANSHORN PowerCube Ergo System liefert detaillierte Informationen zur Diagnose, Therapie oder Trainingsbetreuung.
LFX
Die neue Generation medizinischer Software – Made by GANSHORN
Effizienz, Präzision, hohe Qualität, Benutzerfreundlichkeit: GANSHORN nutzt seine knapp 40-jährige Erfahrung in der Lungenfunktionsdiagnostik, um eine Software zu entwickeln, welche die Diagnose von Patienten auf einfachste Art und Weise ermöglicht.
Provo.X

Der Provo.X ist ein von GANSHORN entwickeltes messplatzunabhängiges Aerosol-Dosimeter, das sekundenschnell spezifische oder unspezifische Provokationen durchführen kann.
PFT-Filter

Zuverlässiger, sicherer und einfach zu benutzender Filter für die Lungenfunktionsdiagnostik.
Hochpräzise Technologie
Basierend auf Ultraschall-Durchflusssensor-Technologie
Weltweiter Service
Unsere Geräte sind weltweit im Einsatz und werden durch unseren Service betreut
Beratung, Herstellung & Service
Kurze Dienstwege: Alles aus einer Hand.
Unsere Wirkungsbereiche
- Lungenfachärzte
- Allgemeinärzte
- Krankenhäuser
- Kinderärzte
- Sportmedizin
