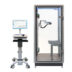
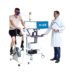
Nach intensiver Vorbereitung, einschließlich umfangreicher Dokumentation sowie intensiver und herausfordernder Tests zur Biokompatibilität, Cybersecurity und weiteren relevanten Prüfkriterien, hat GANSHORN Anfang Dezember 2024 die Zulassung der US-amerikanischen Gesundheitsbehörde FDA (Food and Drug Administration) für die Vermarktung der PowerCube+ Serie erhalten. Diese Genehmigung erschließt GANSHORN den Zugang zum größten Markt der Welt im Bereich der pneumologischen Diagnostik und ermöglicht es, die Geräte PowerCube Body+ und PowerCube Diffusion+ nun auch in den USA anzubieten.
Die seit Jahrzehnten etablierte PowerCube+ Serie von GANSHORN steht für erstklassige Qualität und höchste Präzision in der Diagnostik und Überwachung obstruktiver sowie restriktiver Lungenerkrankungen, ebenso wie bei Diffusionsmessungen und PFT-Tests. Dabei steht der Patient mit seiner Gesundheit durch kontinuierliche Überwachung und hohen Bedienkomfort im Mittelpunkt.
Alle Produkte der PowerCube+ Serie sind mit dem innovativen und kalibrierungsfreien SharpFlow-Ultraschallsensor ausgestattet. Dieses Herzstück der Geräte liefert schnelle, zuverlässige und präzise Ergebnisse, die Anwender und Patienten gleichermaßen überzeugen.
Die Vermarktung über SCHILLER Americas beginnt umgehend. Erste Absatzmöglichkeiten liegen bereits vor, und die Freude über die erfolgreiche Zulassung ist nicht nur in Europa, sondern auch „über dem großen Teich“ sehr groß.
Zudem haben alle Geräte der PowerCube Body+ Serie nun auch die MDR-Zertifizierung erhalten. Dies spiegelt das kontinuierliche Engagement bei der Einhaltung von Vorschriften und Sicherheit der Patienten wider. Bis heute hat GANSHORN die Produkte der SpiroScout-, SpiroDef- und PowerCube+-Serien erfolgreich in Übereinstimmung mit den Anforderungen der EU MDR 2017/745 gebracht.
GANSHORN bedankt sich bei allen Beteiligten für ihre Unterstützung in den Zulassungsverfahren.